Capítulo 6a. Paranfistomidosis
Por Marcelo Rojas C. , Teófilo Torrel P.
La numeración del Capítulo, obedece a la necesidad de hacer un agregado al listado de capítulos de la segunda edición impresa, puesto que la numeración de los cuadros y figuras, resulta complicado volverlas a manejar. Tal ausencia, para entonces, obedecía a la falta de presencia importante en la sanidad, a diferencia de del nivel reemergente que ahora tiene.1 https://mrojas.perulactea.com/https://mrojas.perulactea.com/wp-content/uploads/2013/05/Perulactea-PARAMPHISTOMUM-PDF-2.pdf
El nombre españolizado del parasitismo o enfermedad parasitaria, se origina en la necesidad de representar al efecto de varios Géneros de la Familia Paramphistomidae.
La paramphistomidosis, se presenta con frecuencia en bovinos jóvenes, en regiones cálidas, es una gastroenteritis aguda o subaguda, a veces mortal, causada por invasión masiva de la mucosa del abomaso, duodeno e inicios del yeyuno, por estadios juveniles de varios géneros de trematodos de la familia Paramphistomidae; los adultos que parasitan la mucosa, principalmente del rumen y algo de retículo y omaso, se dice, que rara vez producen síntomas de la enfermedad, aun en invasiones masivas. ¿Será cierto?; que se sepa no hay evidencias científicas.
Etiología
Como los agentes etiológicos en el Perú se han identificado por lo menos cinco especies: Paramphistomum (P. cervi,2 y P. ichikawi,3) Cotylophoron panamensis,3 Cotylophoron cotylophorum,3 y Calicophoron microbothrioides.4
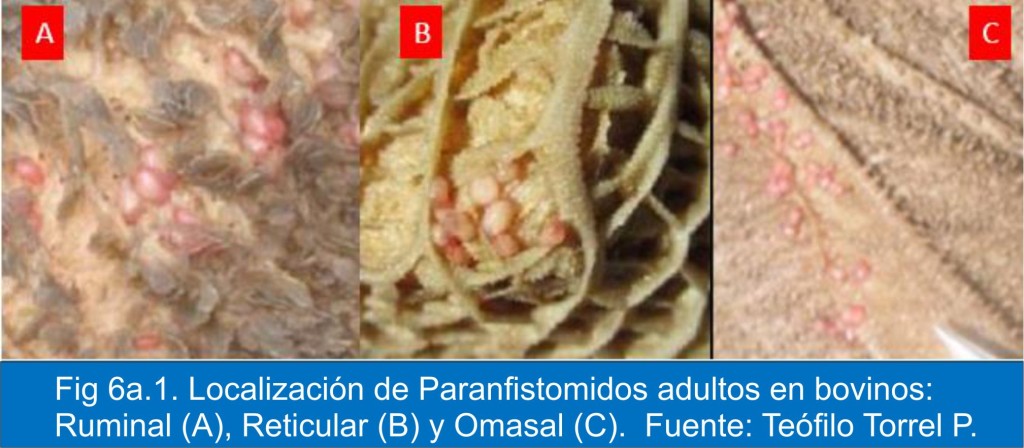
En la Fig 6a.1, se muestra la localización del parásito adulto, en registros de estudios pioneros de Torrel en Cajamarca.5
Se anota que la localización un omaso, no es señalada en la literatura académica.
Ciclo biológico
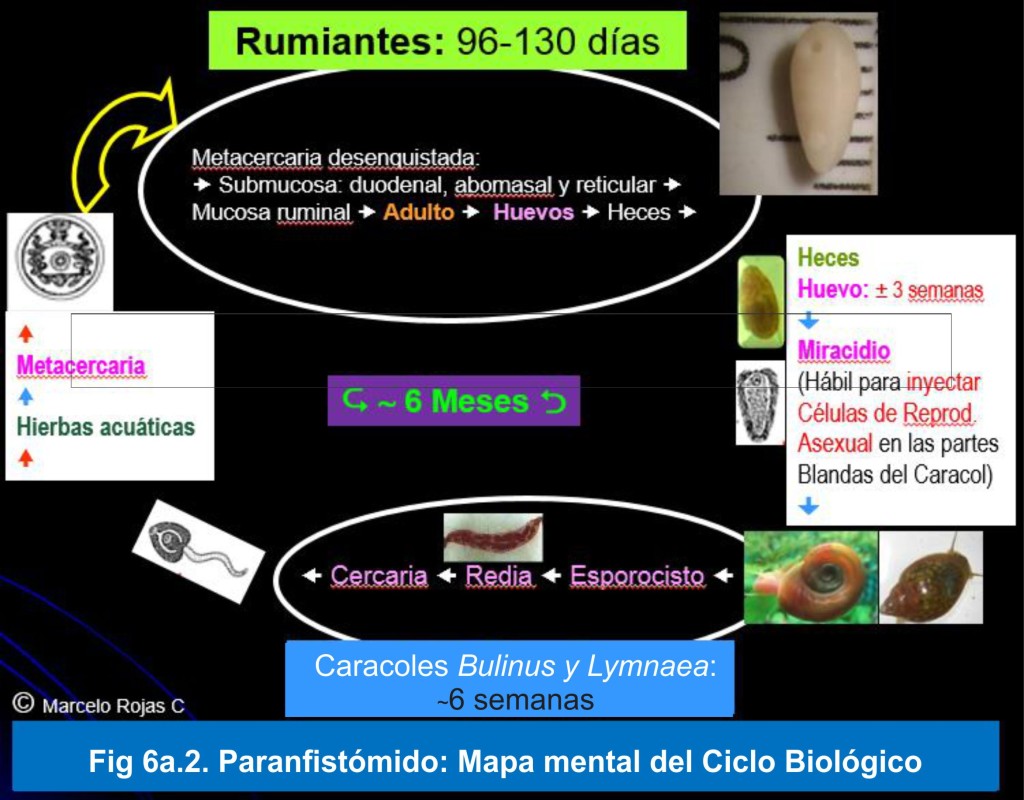
En la Fig 6a.2, se muestra el ciclo vital elaborado en base a las referencias como: Dirksen,6 para el periodo pre patente, y a Abrous,7 para el desarrollo en el hospedero intermediario.
Epizootiología
Desde el hallazgo del Paramphistomum cervi en Maynas, y luego de su identidad allá por 1975,2 este y otros paranfistómidos, se ha ido dispersando, (al parecer lentamente, o siempre estuvieron presente) a otras latitudes del país, como la Selva Alta y la Sierra. De manera que ahora se ubican dentro del concepto de: infecciones emergentes (nuevo aparecido en los últimos 30 años) y reemergentes (reapareció en mayor prevalencia en los últimos 20 años); términos que fue acuñado por el microbiólogo Premio Nobel de medicina en 1952, J. Lederberg.8
La dispersión de esta parasitosis guarda similitudes con la fasciolosis; de manera que conceptualmente, los factores intervinientes de la fasciolosis puede ser útil para aplicarla y entender a la paranfistomidosis.
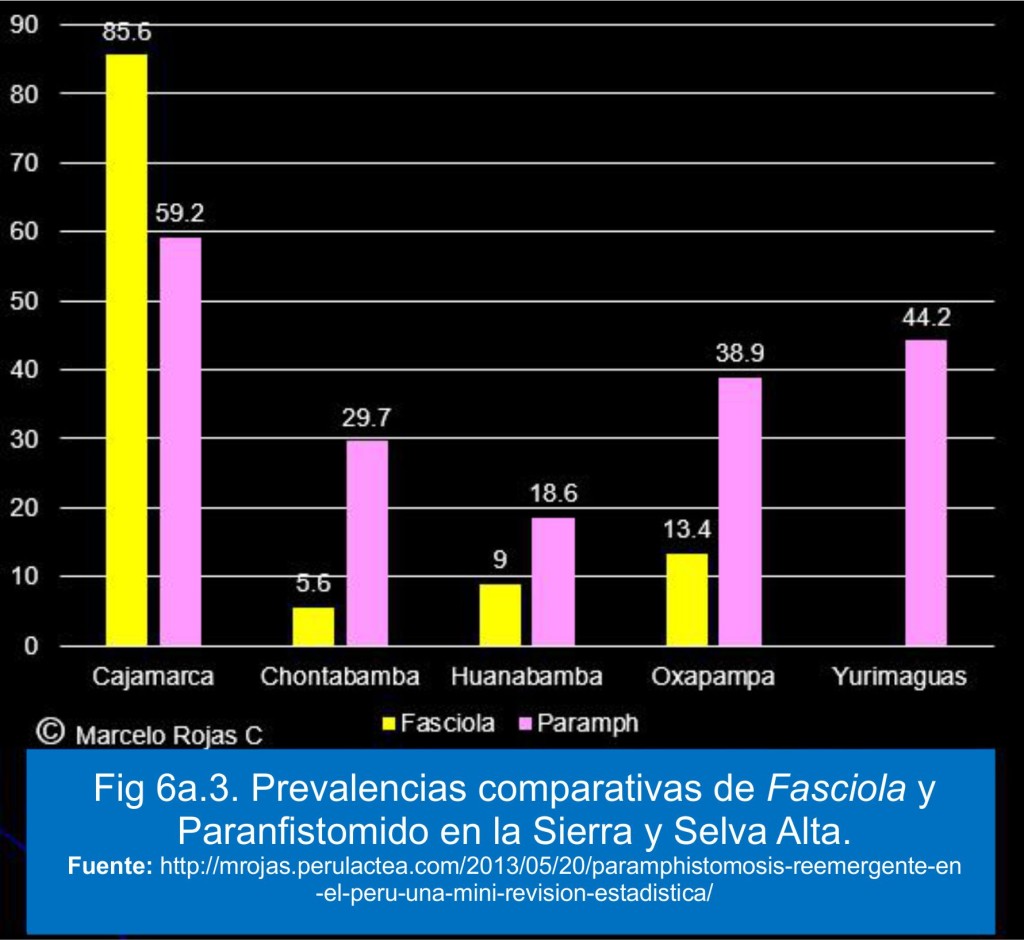
En este orden de ideas la Fig 6a.3, al mismo tiempo que muestra la prevalencias disponibles para el caso de la paranfistomidosis, se pone en inmediata comparación con la ocurrencia de la fasciolosis. Se puede apreciar que en la Selva Alta es notoriamente más alta que la fasciolosis, a diferencia de la ocurrencia en Cajamarca, aunque manteniendo una notoria elevada prevalencia.
Pero lo importante es que los Paramphistomidos, por un lado, ahora es un parasitismo reemergente de prevalencia importante, y por otro, se ha visto que hay más de una especie; y por ello los investigadores peruanos han preferido ahora usar el término Paramphistómido.
A propósito de esta presentación, es conveniente sugerir que los estudios se orienten al hallazgo de información conjunta o de coparasitismos: Fasciola / Paramphistómido. Después de todo, se va usar el mismo material de investigación. Tal recomendsación se muestra en el estudio de Torrel.9
Fisiopatología
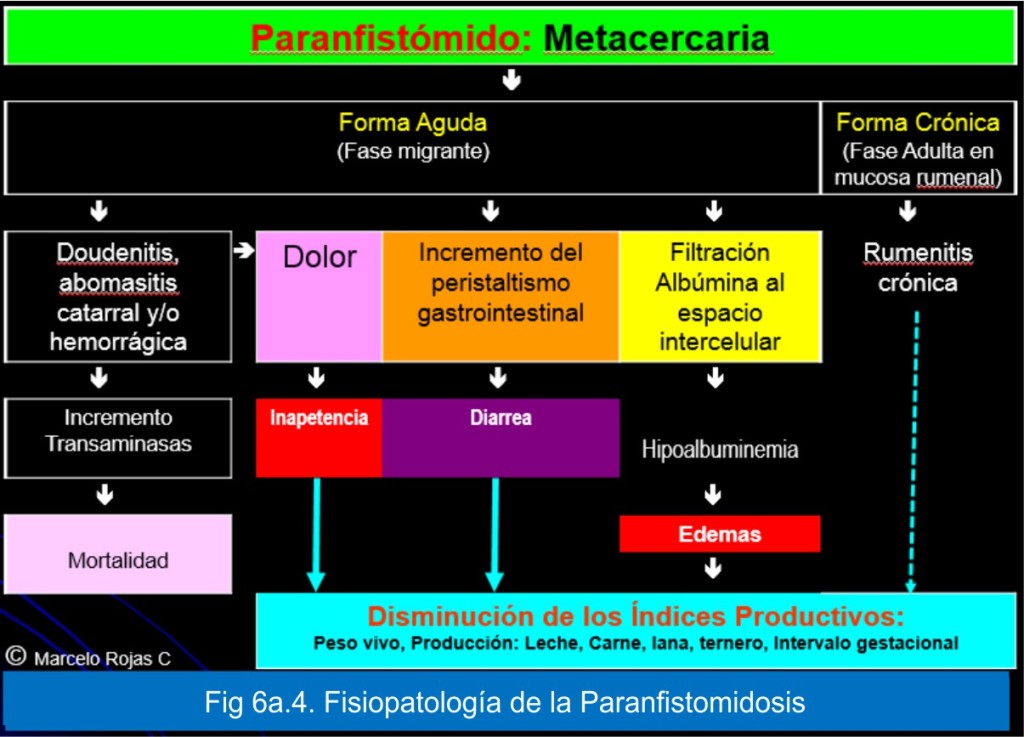
A partir del estudio de Rolfe y cols:10 “Corderos infectados 40 000 a 50 000 metacercarias de Paramphistomum ichikawai, vía ruminal, y necropsiados a los 21, 42 y 84 días después de la infección: Se observaron severos cambios histopatológicos el intestino delgado y rumen. Se registraron el número de parásitos y su ubicación en el tracto gastrointestinal, asi como los estimados de las poblaciones de eosinófilos, mastocitos y leucocitos. Los cambios variaron, según el número de trematodos presentes, de una enteritis localizada y atrofia de las vellosidades en el duodeno en infecciones leves a destrucción severa de la mucosa que se extiende en la mayor parte del yeyuno, en infecciones graves. Cuando la infección progresó, los cambios se caracterizaron por una extensa engrosamiento y fibroplasia en la mucosa y submucosa. También se observó el daño severo en la mucosa del rumen en infecciones graves. Las infecciones graves se asociaron con aumento de la infiltración con eosinófilos. Los mastocitos generalmente se agotan y los leucocitos sólo aparecieron después que los trematodos habían dejado el intestino delgado. La migración de los trematodos del intestino delgado se retrasó en las infecciones mayores que exacerban el efecto de la infección. Se sugiere que la presencia de 20.000 a 25.000 trematodos daría lugar a la enfermedad clínica; números más pequeños podrían causar enfermedad subclínica significativo”; y haciendo una interpretación conceptual, se ha elaborado la Fig 6a.4, para sistematizar la sintomatología: Mortalidad, inapetencia, diarrea, edemas y disminución de la producción animal.
Diagnóstico
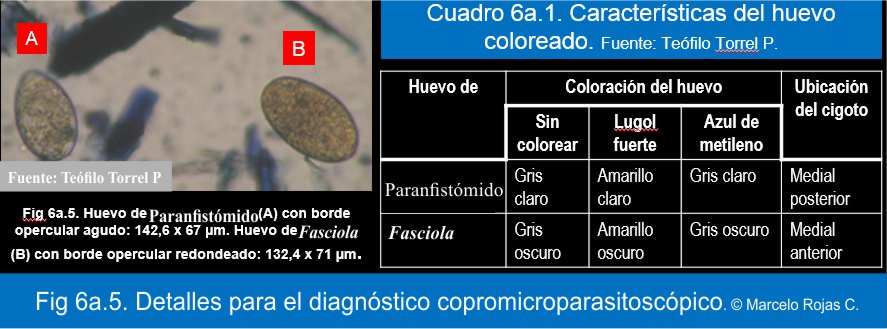
Mediante el examen copromicroparasitoscópico para el hallazgo de los huevos, y con la recomendación de distinguirlo del huevo de Fasciola (Fig 6a.5 y Cuadro 6a.1).
Tratamiento
Para el tratamiento se dispone a: Hexaclorofeno, Niclofolan, Oxaclozanida, Rafoxanide, Febantel; al parecer con mayores efectos sobre las formas inmaduras que sobre los adultos, como ocurre por ejemplo con: Biotionol, Niclosamida y Resorantel. El Triclabendazol tiene un limitado efecto.
Control y Prevención
1. Mediante el concurso de los antiparasitarios, y dado que el periodo pre patente frisa entre 96-130 días, la frecuencia de tratamiento deberá ser cada 3 meses; de manera teórica, que se anule la posibilidad que el parasito comience a eliminar sus huevos.
2. La otra opción es la Tecnología del riego por aspersión desarrollada por Carlos Paredes Gonzales en Sierra productiva, una tecnología nativa peruana, ya ampliamente extendida por los andragogos Yachachic (campesinos transmisores de saberes) en gran parte de la sierra peruana. Para entenderla objetivamente, se muestra la Fig 6a.6. Ocurre que en el ciclo biológico del parasito hay dos etapas ligadas a la gestión del agua, que afecta profundamente a la secuencia vital del parasito: Para entenderla objetivamente, se ha elaborado la Fig 3. Ocurre que en el ciclo biológico del parasito hay dos etapas ligadas a la gestión del agua, que afecta profundamente a la secuencia vital del parasito:
a. Para que el miracidio (navegante) acceda al caracol, necesariamente tiene que haber un medio líquido, y
b. Para que la cercaría (navegante) logre alcanzar una superficie de adherencia y luego enquistarse (metacercaria), también necesita de un medio líquido.
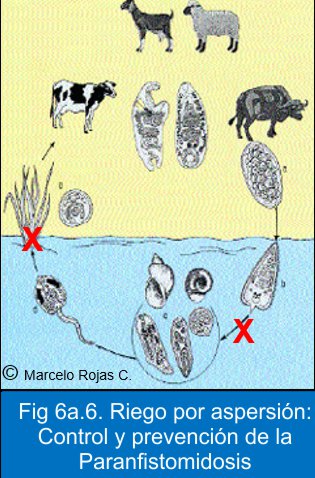
Esta segunda opción también puede y debe ser útil para el control y previsión de la Fasciola hepática; con una gran posibilidad de erradicarlas de predios ganaderos concretos.11
Literatura citada
- Rojas CM. Paramphistomosis reemergente en el Perú: una minirevisión estadística. https://mrojas.perulactea.com/http:/mrojas.perulactea.com/wp-content/uploads/2013/05/Perulactea-PARAMPHISTOMUM-PDF-2.pdf (consultado el 16/02/2014).
- Tantalean M, Martínez R, Juarez D. Estudio de trematodes en el Perú. Rev Peruana de Medicina Tropical. 1975;3-4(1):46-56.
- Tantalean M, Quispe M, Serrano E. Primer registro para el Perú de Cotylophoron panamensis Price & Macintoch, 1963 y Paramphistomum ichikawai Fukui, 1922 (Trematoda: Paramphistomidae). http://sisbib.unmsm.edu.pe/bibvirtualdata/congres/basic/icbar_xxi/cap08.pdf (consultado 16/03/2014).
- Ortiz P, Cabrera M, y cols. Calicophoron microbothriodides: un agente causal de la paranfistomosis en Cajamarca, Perú. XXII PANVET.2010:253.
- Torrel PT. Paramphistomosis en Cajamarca. Fac Ciencias Vet. Univ Nac de Cajamarca. 2008:20.
- Dirksen GH, y col. 2005. Medicina interna y cirugía del bovino. 4° edición. Argentina.: Intermedica. 2005:543.
- Abrous M, Rondelaud D, Dreyfuss G. 1999. Paramphistomum daubneyi and Fasciola hepatica: nfluence of temperature changes on the shedding of cercariae from dually infected Lymnaea tuncatula. Parasitology Research 1999;85:765 -769.
- Drotman DP. Emerging infectious diseases: a brief biographical heritage. Emerg Infect Dis 1998;4(3):372-3.
- Torrel PT y cols. Prevalencia conjunta de Paranfistomosis y Fasciolosis en bovino lechero del valle de Cajamarca. https://mrojas.perulactea.com/2014/11/19/prevalencia-conjunta-de-paranfistomosis-y-fasciolosis-en-bovino-lechero-del-valle-de-cajamarca/
- Rolfe PF, Boray JC, Collins GH. Pathology of infection with Paramphistomum ichikawai in sheep. J Parasitol. 1994 Nov;24(7):995-1004.
-
Rojas CM. Resistencia de la Fasciola hepatica a los fármacos: Caso Perú y alternativa de control. https://mrojas.perulactea.com/https://mrojas.perulactea.com/wp-content/uploads/2013/05/Perulactea-Fasciola-RESISTENCIA-PDF3.pdf (consultado 10/08/2014)
Hola Wilder. Gracias por la visita. El libro impreso, no tiene el capitulo de Paranfistomidosis. Es adición, en la forma digital, que luego completaremos (esta pendiente).
Sin embargo, tengo algunos ejemplares de los impresos. Valor S/. 10.00 soles.
Saludos.
– Muy importante la información sobre los dos parásitos y la medicación a usar, gracias
– Consulta el libro en físico don de se puede adquirir.